A descrição mais completa destas primeiras hipóteses sobre a constituição atômica da matéria é encontrada na obra do poeta romano Lucrécio, que viveu no século I a.C. É interessante observar que muitas das idéias dos filósofos gregos prevalecem ainda hoje, com algumas modificações conceituais na teoria atômica moderna.
Com o advento da Idade Média, as especulações sobre a constituição atômica da matéria sofreram um declínio, acompanhando a decadência geral observada no pensamento cientifico do mundo ocidental durante aquela fase da História da Civilização.
Por ocasião do Renascimento, época em que ressurgiram as grandes correntes de pensamento cultural, as idéias da teoria atômica foram retomadas e desenvolvidas por vários cientistas que viveram naquele período. Entre os físicos da época, que aceitavam como verdadeira a hipótese da existência dos átomos, podemos citar Galileu, Newton, Boyle, Huyghens, Hooke etc.
R. Hooke chegou mesmo a propor um teoria na qual ele procurava explicar algumas propriedades dos gases como sendo devidas ao movimento e às colisões dos átomos que constituíam estes gases. Assim, Hooke estava lançando as primeiras idéias da Teoria Cinética dos Gases. Entretanto, como Hooke, não possuía suficiente habilidade matemática, ele não conseguiu desenvolver adequadamente sua teoria. Somente em meados do século XVIII o grande físico e matemático Bernoulli deu ínicio a este desenvolvimento.
Daniel Bernoulli e a Teoria Cinética
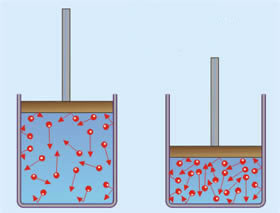
Bernoulli, baseando-se nos estudos de Hooke, admitia que a pressão de um gás deveria ser simplesmente o resultado das colisões dos átomos ou moléculas contra as paredes do recipiente. Com esta hipótese, ele conseguiu facilmente uma explicação para a lei de Boyle: reduzindo-se à metade o volume de um gás, sua densidade duplica. Então, teremos um número de moléculas duas vezes maior colidindo por segundo contra as paredes do recipiente, isto é, a pressão do gás se tornará duas vezes maior. Além disso, Bernoulli conseguiu mostrar matematicamente que a pressão do gás é proporcional ao quadrado da velocidade média das moléculas.
Apesar da importância do trabalho de Bernoulli, que parece ter sido o primeiro na evolução matemática da moderna Teoria Cinética dos Gases, ele foi completamente ignorado pelos outros cientistas do século XVIII. Isto ocorreu, provavelmente, porque Newton havia sugerido um outro modelo para um gás, com qual ele conseguia, também, explicar a lei de Boyle: segundo Newton, um gás seria constituído por partículas, em repouso, que se repeliam com forças inversamente proporcionais à distancia entre elas. Devido ao grande prestígio que Newton desfrutava na época, os cientistas aceitavam praticamente sem contestação qualquer idéia que houvesse sido proposta por ele.
Um valor numérico para a velocidade de uma molécula
No início do século XIX, o físico inglês John Herapath, retomando a linda definida por Bernoulli, conseguiu estabelecer a seguinte relação matemática entre a pressão, p, de um gás, sua densidade, d, e a velocidade média, v, de suas moléculas:
p = 1/3dv²
Esta equação representa um resultado muito importante. Ele permitiu a Herapath determinar a velocidade média das moléculas de um gás, uma vez que os valores de p e d podem ser obtidos experimentalmente. Para as moléculas do ar, por exemplo, Herapath obteve uma velocidade média cerca de 300 m/s. Assim, pela primeira vez na história da Física, foi obtido um valor numérico relacionado com a estrutura molecular da matéria.
De modo semelhante ao que ocorreu com Bernoulli, o trabalho de Herapath não teve aceitação no meio cientifico da época, sendo sua publicação rejeitada pela Real Academia de Ciências de Londres.
A Teoria Cinética adquire sua estrutura definitiva
Poucos anos depois, em 1848, o grande físico Joule, reconhecendo o valor do trabalho de Herapath, tentou reviver as idéias básicas da Teoria Cinética. Inicialmente, seu esforço não foi bem-sucedido, mas, talvez em virtude do prestígio de Joule, não demorou muito para que outros cientistas de renome passassem a se interessar pelos estudos da teoria molecular. Foi assim que, em 1856, o brilhante físico alemão, R. Clausius, publicou um trabalho no qual ele apresentava a Teoria Cinética com uma estrutura praticamente igual àquela aceita atualmente. No final do século XIX, Maxwell (na Inglaterra) e Boltzmann (na Áustria) apresentaram trabalhos complementando a teoria com detalhados desenvolvimentos matemáticos.
Apesar de, com estes trabalhos, a Teoria Cinética dos Gases se encontrar quase totalmente estruturada, um elevado número de grandes cientistas, no início do século XIX, ainda se mostravam descrentes com relação à hipótese da constituição atômico-molecular da matéria. Em outras palavras, eles se recusam a aceitar que os corpos fossem constituídos por átomos ou moléculas em movimento caótico constante, como propunham os adeptos da Teoria Cinética. A comprovação direta da realidade doa átomos e moléculas só veio a ser concretizada com o trabalho de Einstein sobre o “movimento browniano”, publicado em 1905, que analisaremos a seguir.
O movimento Browniano
Este fenômeno, observado pela primeira vez pelo botânico inglês Robert Brown, é assim denominado em homenagem a ele. Brown observou que pequenas partículas (grãos de pólen) em suspensão no interior de um liquido, observadas ao microscópio, apresentavam um movimento constante e inteiramente irregular, mudando sucessivamente de direção. Inicialmente ele pensou que o movimento existia por tratar-se de organismos vivos. Mais tarde, esta idéia teve de ser abandonada, pois constatou-se que o movimento continuava, sem interrupção, durante meses seguidos e, além disso, o mesmo fenômeno podia ser observado com partículas inorgânicas (portanto sem vida) em suspensão.
Passaram-se muitos anos sem que se encontrasse uma explicação adequada para o movimento browniano. Um estudo completo e uma análise matemática desde movimento só vieram a ser desenvolvidos no trabalho mencionado anteriormente, apresentado por Einstein, no início do século XX.
Einstein, que acreditava ser a matéria realmente constituída de átomos e moléculas em constante movimento, estava procurando um fenômeno que tornasse evidente a existência destas partículas. Ele propunha, então, a seguinte explicação para o movimento browniano: estando uma partícula em suspensão no liquido, ela recebe, simultaneamente, os impactos de um número muito grande de moléculas do liquido que, de acordo com a Teoria Cinética, encontram-se em movimento constante e caótico. Eventualmente, a partícula pode receber um maior numero de impactos de um lado do que do outro e isto, evidentemente, provoca um deslocamento desta partícula (que é visível ao microscópio). Logo em seguida, a direção em que há predominância das colisões moleculares se modifica e, então, a partícula passa a se deslocar em uma direção diferente. Portanto, segundo Einstein, o movimento browniano seria uma conseqüência direta do movimento caótico das moléculas do líquido.
 |
| Representação esquemática de uma partícula macroscópica (em amarelo), sofrendo colisões das diversas partículas microscópicas, ou moléculas. |
Desenvolvendo uma analise matemática cuidadosa do fenômeno, Einstein deduziu equações (um tanto complicadas) através das quais ele conseguiu fazer diversas previsões, tais como: o deslocamento das partículas em movimento browniano deve aumentar com o aumento da temperatura, deve ser tanto maior quanto menor for a partícula, deve ser tanto menor quanto maior for a viscosidade de liquido etc. Ao publicar o seu trabalho, Einstein conclamou os físicos experimentais a verificarem, em seus laboratórios, se suas previsões teóricas estavam corretas.
O cientista francês, Jean Perrin, em 1908, observando partículas em movimento browniano e realizando experiências sofisticadas e medidas bastante precisas, conseguiu com grande sucesso comprovar todas as previsões feitas por Einstein. No decorrer de seu trabalho, usando as equações deduzidas por Einstein, foi possível a Perrin determinar o valor do número de Avogadro.
A confirmação experimental da teoria de Einstein sobre o movimento browniano, evidenciando de maneira incontestável a constituição atômica e molecular da matéria, teve enorme repercussão no meio cientifico da época. A partir de então todos os cientistas, mesmo aqueles mais descrentes, convenceram-se definitivamente da realidade dos átomos e moléculas.
fonte: Antônio Máximo e Beatriz Alvarenga in Física, vol 2, editora Scipione, 2005.
Digitalizado e adaptado pela estudante Ana Luísa Pinho do 2 ano do curso e edificações do CEFET/MG em Curvelo-MG




Um comentário:
otimo parabens
Postar um comentário